RNAseq数据,下载GEO中的FPKM文件后该怎么下游分析 by 生信技能树
我们有很多学徒数据挖掘任务,已经完成的目录见:学徒数据挖掘专题半年目录汇总(生信菜鸟团周一见) 欢迎大家加入我们的学习团队,下面看FPKM文件后该怎么下游分析
文献标题是:Oncogenic lncRNA downregulates cancer cell antigen presentation and intrinsic tumor suppression不过不需要看文章,大家只需要做差异分析即可,这个时候需要注意的是,作者提供的是RPKM值表达矩阵!
6个样本,分成2组,是RPKM值表达矩阵,做差异分析,看GO通路,跟文章比较
作业:(f) Enrichment of GO biological process (BP) terms for up-regulated genes (red) and down-regulated genes in tumor versus normal samples (n = 3, 3 animals). (g-i) Log2 of fold changes of indicated metabolites in MMTV-Tg(LINK-A) breast tumor compared to that of Tg(LINK-A) mammary gland (n = 3 animals respectively).
首先需要去GEO数据库下载文件GSE113143_Normal_Tumor_Expression.tab.gz
1.下载数据GSE113143并加载数据
a=read.table('GSE113143_Normal_Tumor_Expression.tab.gz',sep='\t',quote = "",fill = T,
comment.char = "!",header = T) # 提取表达矩阵
rownames(a)=a[,1]
a <- a[,-1]
TPM值就是RPKM的百分比:关于TPM的解释可以看看这个
What the FPKM? A review of RNA-Seq expression units
Question: Differential expression analysis starting from TPM data
2.将FPKM转换为TPM
expMatrix <- a
fpkmToTpm <- function(fpkm)
{
exp(log(fpkm) - log(sum(fpkm)) + log(1e6))
}
tpms <- apply(expMatrix,2,fpkmToTpm)
tpms[1:3,]
colSums(tpms)
#输出结果:
> tpms[1:3,]
N1 N2 N3 T1 T2 T3
0610005C13Rik 0.232 0.1715 0.00 0.00 0.00 0.00
0610007P14Rik 48.391 39.2632 46.04 50.04 59.05 67.29
0610009B22Rik 47.491 58.5954 54.27 49.79 53.13 58.00
> colSums(tpms)
N1 N2 N3 T1 T2 T3
1e+06 1e+06 1e+06 1e+06 1e+06 1e+06
3.差异分析
group_list=c(rep('Normal',3),rep('Tumor',3))
## 强制限定顺序
group_list <- factor(group_list,levels = c("Normal","Tumor"),ordered = F)
#表达矩阵数据校正
exprSet <- tpms
boxplot(exprSet,outline=FALSE, notch=T,col=group_list, las=2)
library(limma)
exprSet=normalizeBetweenArrays(exprSet)
boxplot(exprSet,outline=FALSE, notch=T,col=group_list, las=2)
#判断数据是否需要转换
exprSet <- log2(exprSet+1)
#差异分析:
dat <- exprSet
design=model.matrix(~factor( group_list ))
fit=lmFit(dat,design)
fit=eBayes(fit)
options(digits = 4)
topTable(fit,coef=2,adjust='BH')
bp=function(g){
library(ggpubr)
df=data.frame(gene=g,stage=group_list)
p <- ggboxplot(df, x = "stage", y = "gene",
color = "stage", palette = "jco",
add = "jitter")
# Add p-value
p + stat_compare_means()
}
deg=topTable(fit,coef=2,adjust='BH',number = Inf)
head(deg)
#save(deg,file = 'deg.Rdata')
划重点:以下代码、方法全来自生信技能树的最新推文:为R包写一本书(向Y叔致敬)
这里面重点就是:RPKM矩阵可以转为TPM后,再使用limma进行差异分析哦!
4.做完差异分析
GEO数据挖掘代码,很容易得到上下调基因,而且转为ENTREZID,后续分析都以这个为主线。
根据原文文献中:
Differential gene expression was defined if the fold change >1.5 and P < 0.05 between tumor and normal samples找差异基因
## 不同的阈值,筛选到的差异基因数量就不一样,后面的超几何分布检验结果就大相径庭。
if(T){
logFC_t=1.5
deg$g=ifelse(deg$P.Value>0.05,'stable',
ifelse( deg$logFC > logFC_t,'UP',
ifelse( deg$logFC < -logFC_t,'DOWN','stable') )
)
table(deg$g)
head(deg)
deg$symbol=rownames(deg)
library(ggplot2)
library(clusterProfiler)
library(org.Mm.eg.db)
df <- bitr(unique(deg$symbol), fromType = "SYMBOL",
toType = c( "ENTREZID"),
OrgDb = org.Mm.eg.db)
head(df)
DEG=deg
head(DEG)
DEG=merge(DEG,df,by.y='SYMBOL',by.x='symbol')
head(DEG)
save(DEG,file = 'anno_DEG.Rdata')
gene_up= DEG[DEG$g == 'UP','ENTREZID']
gene_down=DEG[DEG$g == 'DOWN','ENTREZID']
}
5.最简单的超几何分布检验
# 最简单的超几何分布检验
###这里就拿KEGG数据库举例吧,拿自己判定好的上调基因集进行超几何分布检验,如下
if(T){
gene_down
gene_up
enrichKK <- enrichKEGG(gene = gene_up,
organism = 'mmu',
#universe = gene_all,
pvalueCutoff = 0.05,
qvalueCutoff =0.05)
head(enrichKK)[,1:6]
browseKEGG(enrichKK, 'hsa04512')
dotplot(enrichKK)
ggsave("enrichKK.png")
enrichKK=DOSE::setReadable(enrichKK, OrgDb='org.Mm.eg.db',keyType='ENTREZID')
enrichKK
}
##最基础的条形图和点图
#条带图
barplot(enrichKK,showCategory=20)
#气泡图
dotplot(enrichKK)
通路与基因之间的关系可视化
#通路与上调基因之间的关系可视化
###制作genlist三部曲:
## 1.获取基因logFC
DEG_up <- DEG[DEG$g == 'UP',]
geneList <- DEG_up$logFC
## 2.命名
names(geneList) = DEG_up$ENTREZID
## 3.排序很重要
geneList = sort(geneList, decreasing = TRUE)
head(geneList)
cnetplot(enrichKK, categorySize="pvalue", foldChange=geneList,colorEdge = TRUE)
cnetplot(enrichKK, foldChange=geneList, circular = TRUE, colorEdge = TRUE)
ggsave("enrichKK_cnetplot.png")
通路与通路之间的连接展示
#通路与通路之间的连接展示
emapplot(enrichKK)
ggsave("enrichKK_emapplot.png")
热图展现通路与基因之间的关系
#热图展现通路与基因之间的关系
heatplot(enrichKK)
ggsave("enrichKK_heatplot.png")
如果你是做GO数据库呢,其实还有一个goplot可以试试看,当然是以Y叔的书为主啦。
#如果你是做GO数据库呢,其实还有一个goplot可以试试看
ego_bp_up<-enrichGO(gene = DEG_up$ENTREZID,
OrgDb = org.Mm.eg.db,
keyType = 'ENTREZID',
ont = "BP",
pAdjustMethod = "BH",
pvalueCutoff = 0.01,#0.01
qvalueCutoff = 0.05)
goplot(ego_up)
ggsave("ego_bp_up_goplot.png")
head(ego)
library(stringr)
barplot(ego_bp_up,showCategory = 16,title="The GO_BP enrichment analysis of all DEGs ")+
scale_size(range=c(2, 12))+
scale_x_discrete(labels=function(ego_bp) str_wrap(ego_bp,width = 25))
ggsave("ego_bp_up_barplot.png")
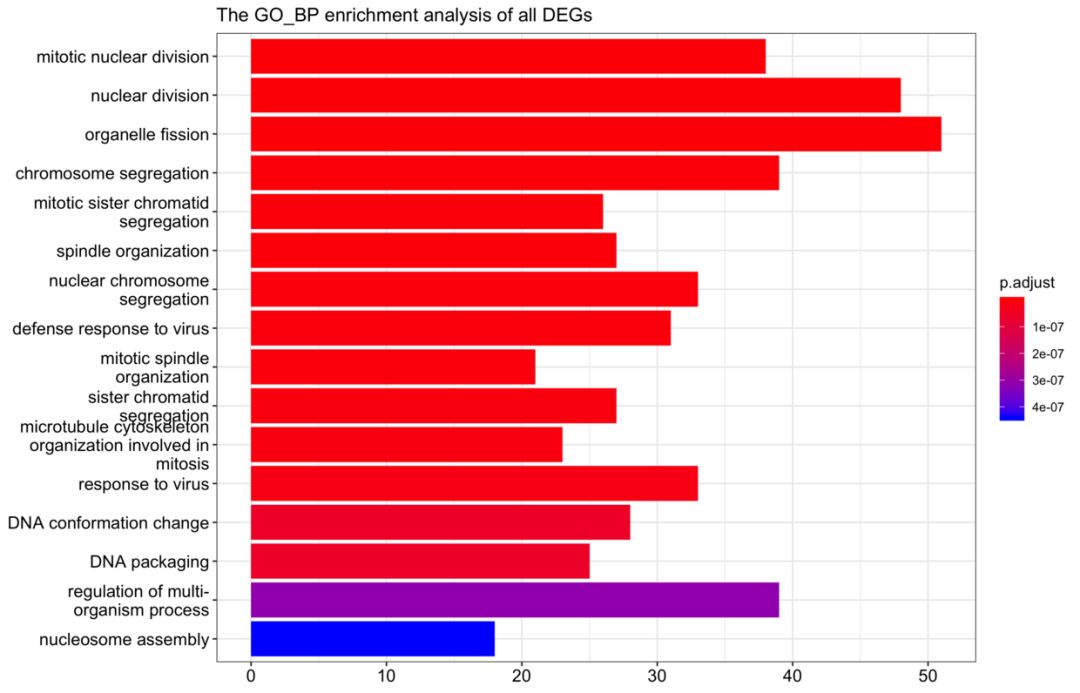
ego_up_barplot.png
同样的方式看看下调基因的GO_BP:
down_regulated_genes.png
和文献中的GO_BP比较一下
GO_BP
https://mp.weixin.qq.com/s/_DtkxSfLGQHcRju66J4yTQ